Imagerie des complications de la drépanocytose hors complications neurovasculaires
Suzanne Verlhac
A. Manifestations cliniques
a. Chez le nourrisson
b. Chez l’enfant
1. Les crises douloureuses vaso-occlusives dominent le tableau :
1) Physiopathologie
2) Clinique
3) L’ostéomyélite
4) Les ostéonécroses
2. Le syndrome thoracique aigu
3. Lithiase biliaire et boue biliaire
4. Estimation de la surcharge en fer par IRM hépatique
5. Complications spléniques
6. Complications rénales
B. Protocole de prise en charge
C. Bibliographie
Retour à l'accueil
Mise à jour 05 octobre 2008
Imagerie des complications de la drEpanocytose hors complications neurovasculaires
Suzanne Verlhac
Centre hospitalier intercommunal Créteil 94, Hôpital Robert Debré Paris 19ème
Centre de référence des Syndromes Drépanocytaires Majeurs.
suzanne.verlhac@chicreteil.fr
http://drepanosite.free.fr
Hier cantonnée au statut de « maladie exotique », la drépanocytose est devenue sous les effets conjugués du gain d’espérance de vie des malades et de l’accroissement des populations migrantes d’origine africaine, la première maladie génétique en France à l’origine de nombreuses consultations et hospitalisations (Fournier). La diminution de la mortalité et morbidité dépend largement du diagnostic précoce des complications et même pour certaines d’entre elles, en particulier l’AVC, de leur prévention. Le radiologue pédiatrique occupe une place centrale dans l’équipe multidisciplinaire prenant en charge ces patients. Le but de ce travail est décrire les manifestations cliniques des complications les plus fréquentes émaillant la vie d’un enfant drépanocytaire, de discuter des indications et performances des techniques d’imagerie à la disposition du radiologue pédiatrique et de définir la place de l’imagerie dans la stratégie de prévention et de prise en charge précoce de ces complications.
A. Manifestations cliniques
La clinique est dominée chez l’enfant par les 3 aspects : anémie hémolytique chronique et épisodes d’accentuation aigue de l’anémie; accidents vaso-occlusifs ; infections.
a. Chez le nourrisson
Le risque de manifestations précoces avant l’âge d’un an ne concerne pratiquement que les patients SS et serait un témoin de sévérité de la maladie. Le risque de séquestration splénique existe dès les premiers mois : il s’agit d’une complication redoutable pouvant être fatale. Les drépanocytes sont piégés dans la rate qui grossit brutalement, entraînant ainsi une anémie majeure pouvant entraîner la défaillance cardiaque. Le risque infectieux existe également très précocement, l’asplénie fonctionnelle pouvant survenir dès les premiers mois de vie. Il s’agit surtout d’un risque de septicémie foudroyante associée ou non à une atteinte méningée à pneumocoque. D’où l’antibioprophylaxie systématique dès l’âge de 2 mois par Pénicilline orale, la vaccination antipneumococcique par le Prévenar et l’hospitalisation systématique de tous les nourrissons fébriles (> 38°5) pour bilan sanguin avec hémoculture et antibiothérapie IV.
Les premières crises vaso-occlusives surviennent le plus souvent sous forme du Syndrome Pieds-Mains. Il s’agit d’une crise douloureuse des extrémités avec un gonflement du dos des mains et des pieds associé souvent à un gonflement des doigts (dactylite). Elle ne nécessite pas de bilan d’imagerie et généralement pas d’hospitalisation en absence de fièvre importante. Le plus souvent, les mesures d’hydratation orale et les antalgiques associant paracétamol, ibuprofène et codéine suffisent dans un premier temps. Par contre, la survenue secondaire d’une fièvre ou l’apparition de symptômes pulmonaires impose l’hospitalisation, toute crise vaso-occlusive étant susceptible de se compliquer secondairement du syndrome thoracique tant redouté.
b. Chez l’enfant
1. Les crises douloureuses vaso-occlusives dominent le tableau :
1) Physiopathologie
A la naissance, la moelle rouge hématopoïétique est présente dans tout le squelette, puis se produit chez l’enfant non drépanocytaire une conversion progressive en moelle jaune graisseuse au cours de la croissance dans le squelette périphérique. La conversion médullaire se produit d’abord dans les diaphyses des os longs et les épiphyses où elle est terminée à 5 ans chez 95% des enfants normaux. La conversion dans les métaphyses se produit ensuite dans la 2ème décennie et est moins complète. A 20-25 ans la conversion est complète. La moelle rouge ne persiste que dans le squelette axial (vertèbres, sternum, côtes, clavicules, omoplate, pelvis, crâne)
Chez l’enfant drépanocytaire, l’anémie est responsable d’un défaut de conversion et d’une hyperplasie de la moelle avec persistance de la moelle rouge dans le squelette périphérique, moelle très vascularisée avec des petits vaisseaux sinusoïdes, terrain favorable au ralentissement du flux, à l’hypoxie tissulaire, à la falciformation des hématies et finalement aux infarctus. On note chez l’enfant drépanocytaire un hyposignal T1 des métaphyses et des diaphyses comparable à celui des muscles, très différent de l’hypersignal d’un enfant non drépanocytaire du même âge. L’hyposignal T1 et T2 peut être accentué par le dépôt de fer secondaire aux transfusions. La moelle rouge peut être présente aussi dans les épiphyses en particulier dans la tête fémorale et la tête humérale.
2) Clinique
Les crises vaso-occlusives sont souvent déclenchées par un effort physique trop intense, une séance de piscine. Elles peuvent aussi survenir spontanément ou à l’occasion d’une virose. Elles concernent le plus souvent les membres et les articulations mais elles peuvent être aussi abdominales ou thoraciques touchant les côtes et le sternum. La douleur peut être isolée ou associée à une tuméfaction, érythémateuse avec augmentation de chaleur locale ne traduisant pas forcément une surinfection. Elle résulte d’une ischémie tissulaire par ralentissement du flux et occlusion microvasculaire. Les radiographies standard ne sont pas indiquées, les modifications osseuses étant retardées de 1 à 2 semaines après la crise. Dans la plupart des cas le traitement associant repos, antalgiques et hydratation entraîne la résolution de la crise. Deux complications peuvent survenir : le syndrome thoracique aigu et la surinfection.
Des atteintes musculaires ont été décrites avec gonflement douloureux inflammatoire des muscles souvent associé à un épanchement des articulations voisines.
Les CVO articulaires sont fréquentes. Elles pourraient être liées à une ischémie synoviale ou à un infarctus osseux juxtaarticulaire. Elles touchent le plus souvent le genou et le coude. L’échographie met en évidence l’épanchement articulaire.
3) L’ostéomyélite
L’ostéomyélite, en fait rare, est suspectée devant une tuméfaction, une prolongation de la crise de plus de 48h, une fièvre > 38°5. Elle résulte d’une prolifération bactérienne dans les sinusoïdes de la moelle hématopoétique favorisée par le ralentissement du flux circulatoire et la susceptibilité aux infections du fait de la diminution de la réponse immunitaire. La distinction infection/infarctus est difficile. L’infarctus est au moins 50 fois plus fréquent (l’ostéomyélite n’a été retrouvée que dans 1,6 % des CVO dans l’étude de Dalton portant sur 247 CVO chez 113 enfants sur 2 ans). L’oedème, la douleur, l’augmentation de la chaleur locale sont présents dans les deux cas, la fièvre et l’hyperleucoctose aussi. L’IRM ne permet pas non plus de différentier les deux entités avec fiabilité. Dans les deux cas, il existe un œdème médullaire avec plage en hypersignal en DP et T2 diaphysaire ou diaphysométaphysaire et souvent un hypersignal périosté et des tissus périosseux. Les limites seraient plus floues dans l’ostéomyélite. La séquence T1 FAT SAT après injection de Gadolinium serait la plus sensible et spécifique montrant une prise de contraste en plage dans l’ostéomyélite et serpigineuse dans l’infarctus. Malheureusement ce signe décrit chez l’adulte n’est pas retrouvé chez l’enfant. Dans une étude prospective (Mankad) des modifications IRM étaient notées dans 35,7% des CVO, généralement avec un gonflement des tissus mous à l’examen. L’infarctus récent et ancien se manifeste par un hyposignal T1 et un hypersignal T2. La scintigraphie médullaire avec agents pour l’infection gallium 67 citrate et indium 111 permettrait de différencier l’infarctus avec diminution de la captation et l’infection où elle est normale, si faite précocement. En fait ses performances sont pauvres sur un os déjà malade au comportement modifié par l’hyperplasie médullaire et les infarctus. Finalement seul l’isolement du germe dans les hémocultures et par aspiration locale permet un diagnostic de certitude et c’est tout l’intérêt de l’échographie atraumatique et facilement répétée qui identifie une collection sous périostée ou articulaire pouvant être ponctionnée. Dans une étude prospective du Moyen-Orient (William) portant sur 31 enfants, l’échographie a une sensibilité de 74% et une spécificité de 63% dans le diagnostic d’OM en présence d’une collection sous périostée de 4 mm ou plus. Dans la CVO non compliquée, il est fréquent de voir un petit décollement périosté avec œdème sous périosté hypoéchogène de moins de 4 à 10 mm selon les études. Salmonelle est l’organisme le plus souvent en cause, suivi de staphylococcus aureus puis d’autres germes (colibacille, pneumocoque, haemophilus influenzae…)
4) Les ostéonécroses
Les ostéonécroses épiphysaires sont des complications fréquentes et invalidantes de la drépanocytose, affectant à la même fréquence la hanche et l’épaule. La drépanocytose est la cause la plus fréquente d’ostéonécrose de la tête fémorale chez l’enfant et environ la moitié des patients drépanocytaires vont avoir une ostéonécrose épiphysaire à l’âge de 35 ans. L’ONA peut se manifester par des douleurs et une limitation des mouvements, mais dans 30 à 50% des cas, elle n’a pas de manifestation clinique. Un diagnostic précoce de la nécrose fémorale a un impact sur la prise en charge et l’évolution. L'âge moyen de survenue chez l'enfant est de 12 ans, mais elle peut se voir dès l’âge de 3 ans. La nécrose est souvent bilatérale et la moitié des patients vont développer une nécrose d’une autre épiphyse (hanche ou épaule) dans les deux ans suivant la première nécrose. La classification de Steinberg classe les nécroses en 7 stades cotés de 0 à 6 en intégrant les données de la radio et de l’IRM et en prenant en compte à la fois le type de modification radiologique et l’extension des lésions.
. 
Lors d’une crise vaso-occlusive du bassin, L’IRM est justifié de manière à avoir une idée précise de l’étendue et de la localisation de la nécrose. En IRM, les lésions peuvent être identiques à celle d’une ostéonécrose d’autre origine, avec au stade précoce un liseré en hyposignal T1 et T2 arciforme à concavité supérieur sous chondral habituellement antérieur délimitant une zone de signal variable, mais elles sont souvent moins typiques, car la conversion graisseuse de la tête est inconstante chez l’enfant drépanocytaire et l’os est remanié par des épisodes d’infarctus antérieurs. La séquence après injection de gadolinium permet d’évaluer l’extension et la topographie de l’ischémie.


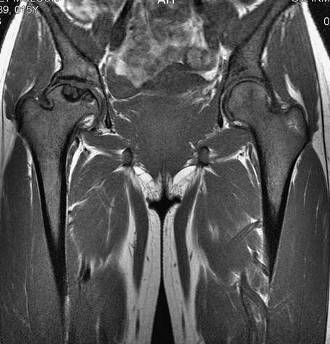
IRM image coronale SE T1 1

IRM image coronale SE T2 FAT SAT

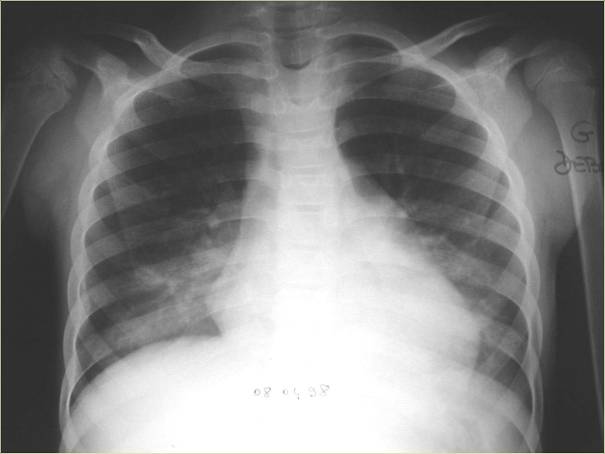
Le parenchyme pulmonaire était normal sur la radiographie thoracique à l'entrée.
Le mécanisme de l’ONA est discuté. L’épiphyse est un système clos avec une artère nourricière et une veine de drainage. Une explication possible est que la stase veineuse par hyperviscosité sanguine entraîne une augmentation de la pression dans la tête, la diminution du débit de l’artère et l’hypoxie médullaire et de l’os.
2. Le syndrome thoracique aigu
Le syndrome thoracique aigu est défini par l’apparition d’un infiltrat radiologique pulmonaire associé à un ou plusieurs des signes suivants : toux, polypnée, dyspnée, douleur thoracique, hypoxie, fièvre. Il correspond à un phénomène vaso-occlusif aboutissant à un infarctus pulmonaire. L’occlusion vasculaire peut être due à une embolie graisseuse à partir du lieu de la CVO osseuse, à une thrombose capillaire in situ favorisée par l’hypoventilation (elle-même en rapport avec la douleur thoracique d’une CVO sternale ou costale ou au contraire avec la sédation morphinique). La responsabilité d’une infection bactérienne et/ou virale est rarement démontrée en pratique clinique. Cependant lorsque des investigations microbiologiques plus complètes sont faites, une infection est retrouvée chez environ un tiers des patients avec une fréquence égale d’infections à mycoplasma pneumoniae et chlamydia pneumoniae. Il concerne environ 1/3 des patients drépanocytaires et représente une cause majeure d’hospitalisations et de décès. Son incidence est inversement corrélée à l’âge, maximale entre 2 et 4 ans.
Environ la moitié des patients qui développent un STA sont admis pour un autre motif et cette complication survient en moyenne 2,5 jours après le début de l’hospitalisation. Ainsi, toute hospitalisation d’un patient drépanocytaire, que ce soit pour une CVO, une fièvre ou une intervention chirurgicale est une circonstance à risque de STA. Comme l’examen pulmonaire peut être normal, la réalisation systématique de la radiographie de thorax est conseillée en cas de fièvre chez l’enfant drépanocytaire.
Elle montre habituellement une condensation alvéolaire des lobes inférieurs unique ou multiple, parfois au niveau des lobes supérieurs chez les patients plus jeunes. L’épanchement pleural est fréquent. L’apparition et la disparition des images radiologiques sont généralement rapides. Le traitement comporte une antibiothérapie associant une érythromycine (clarythromycine de préférence) à l’amoxicilline ou une céphalosporine, l’oxygénothérapie, une hydratation modérée de 2l/m2, la spirométrie incitative et le plus souvent une petite transfusion de 10 ml/kg est prescrite avant de discuter un éventuel échange si l’infiltrat et les signes cliniques progressent. La tomodensitométrie n’est généralement pas indiquée dans cette situation, car il n’y a pas d’indication au traitement anticoagulant.
3. Lithiase biliaire et boue biliaire
La lithiase biliaire est fréquente et peut être responsable de certains épisodes douloureux abdominaux. Sa prévalence augmente avec l’âge : 8,7% à 5 ans, 28,9% à 10 ans dans la série de Créteil. Une cholécystectomie par coelioscopie est proposée en cas de lithiase biliaire, même asymptomatique, a fortiori si l’enfant ou l’adolescent a déjà présenté une complication de migration calculeuse dans la voie biliaire principale (cholécystite, pancréatite). La présence de boue biliaire doit conduire à une surveillance échographique semestrielle, la boue biliaire conduisant le plus souvent à la lithiase en quelques mois.

Garçon drépanocytaire SS. Douleurs abdominales aigues de l’hypochondre droit depuis quelques jours sans fièvre avec ictère et urines foncées. Echographie : dilatation VBIH et VBP 6.6 mm en amont d’un amas de bile épaisse. Vésicule contenant de la bile épaisse et des calculs. ASP normal.
Cholestase biologique et cytolyse
Evolution pas de fièvre, diminution de l’ ictere
Transfusion et cholecystectomie 4 j plus tard


- Estimation de la surcharge en fer par IRM hépatique
Les transfusions répétées exposent au risque de surcharge en fer toxique pour de nombreux organes (foie, cœur, gonades…). La surcharge se constitue après une vingtaine de transfusions, soit 18 mois-2 ans de programme transfusionnel. L'IRM est une technique sensible à l'existence de fer au sein des tissus et peut ainsi donner une appréciation de la charge hépatique en fer équivalente à celle fournie par la biopsie. Le fer entraîne une baisse importante du signal par effondrement du temps de relaxation T2.
Le principe de calcul est la comparaison du signal du foie avec un organe de référence qui ne présente pas de surcharge comme les muscles paravertébraux. Plusieurs acquisitions sont faites avec des TE de différentes valeurs, pour s'adapter au mieux aux différentes concentrations en fer possibles. Pour chaque séquence il faut relever le signal du foie et des muscles paravertebraux. Il suffit ensuite de rentrer les valeurs dans un logiciel qui applique la formule qui a été établie chez des témoins chez qui avait été réalisée une biopsie avec mesure de la concentration en fer. On trouve la description des séquences et le logiciel de calcul sur le site d’Yves Gandon (Imagerie Médicale, Rennes) de l’université de Rennes http://www.radio.univ-rennes1.fr/Sources/FR/HemoCalc15.html
Pour les surcharges très importantes supérieures à 330 µmol/g, on peut faire une 6ème séquence décrite sur le site de Lille où on trouve aussi le logiciel de calcul adapté. L’estimation de la surcharge peut se faire aussi au niveau du myocarde. http://oernst.f5lvg.free.fr/liver/fer/fer.html

- Complications spléniques
Dès les 6 premiers mois de vie, la pulpe rouge de la rate est congestionnée par les drépanocytes provoquant des infarctus spléniques avec remplacement du parenchyme splénique par du tissu fibreux, résultant en une asplénie fonctionnelle qui expose l’enfant aux infections particulièrement aux germes encapsulés. L’asplénie fonctionnelle est retrouvée chez 30% of patients à 1 an et 90% à 6 ans. A l’échographie la rate est généralement atrophique, parfois hétérogène avec plages échogènes pouvant correspondre à des infarctus, alors que des images hypoéchogènes rondes au sein d’un rate d’échogénicité augmentée pourraient correspondre à des îlots de parenchyme sain. Chez l’enfant plus grand, la rate peut être totalement calcifiée, peut ne pas être retrouvée à l’échographie. La splénomégalie est rare dans la forme SS, elle est fréquente dans les formes HbSC et HbSbeta thalassémie.
- Complications rénales
Les complications rénales sont très rares à l’âge pédiatrique. Il existe cependant un défaut de concentration des urines. Des modifications échographiques, non spécifiques des reins peuvent être observés : néphromégalie qui pourrait être liée à l’augmentation du débit sanguin et à une hypertrophie glomérulaire, augmentation de l’échogénicité diffuse ou limitée à la médullaire.

- Protocole de prise en charge
La prise en charge d’un enfant drépanocytaire repose sur une étroite collaboration avec les parents qui apprennent à reconnaître une accentuation de l’anémie, à palper la rate, à traiter une crise douloureuse, à venir à l’hôpital dès que nécessaire, et sur une étroite surveillance médicale en consultation spécialisée avec une consultation médicale trimestrielle et un bilan annuel au mieux en hôpital de jour visant à dépister et traiter précocement les complications.
Le contenu du bilan varie selon l’âge de l’enfant et le contexte clinique.
IL comprend :
• un bilan biologique : hémogramme , électrophorèse de l’hémoglobine etc
• à partir de 12-18 mois : un -Doppler transcrânien
• à partir de 3 ans : une échographie abdominale, une radiographie de thorax
• à partir de 6 ans : une radiographie de bassin, une échographie cardiaque
• à partir de 6 ans chez les enfants SC et 10 ans chez les enfants SS : un bilan ophtalmologique avec un ophtalmologiste expert en pathologie rétinienne.
- Bibliographie
Revues générales
Recommandations de l’HAS : http://www.has-sante.fr/portail/upload/docs/application/pdf/Drepanocytose_reco.pdf
Crowley JJ, Sarnaik S Imaging of sickle cell disease.Pediatr Radiol. 1999 29(9):646-61.
Monographie de la revue du praticien :05 octobre 2004
Lonergan GJ, Cline DB, Abbondanzo SL. Sickle cell anemia. Radiographics. 2001 Jul-Aug;21(4):971-94
Fournier C, Benkerrou M, Vilmer E, Brodin M, Lombrail P. Evolution de l’activité liée à la drépanocytose à l’hôpital Robert-Debré (Paris), entre 1992 et 1996 Arch Pediatr. 2000 May;7(5):465-73.
Complications neurovasculaires
S Verlhac, F Bernaudin http://drepanosite.free.fr
Verlhac S, Bernaudin F, Tortrat D, et al: Detection of cerebrovascular disease in Sickle Cell Disease children by transcranial doppler sonography. Correlation with MRI and MRA and conventionnal angiography. Pediatric Radiology 1995, 25: S14-S19
Verlhac S, Bernaudin F, Tortrat D et al. Detection of cerebrovascular disease in sickle cell disease children by transcranial Doppler sonography. Correlation with MRI and MRA and conventionnal angiography. Pediatric Radiology 1995; 25: S14-S19
Verlhac S. Exploration de la vasculopathie cérébrale drépanocytaire. Path Biol 1999 ; 47, 1 : 31-38
Bernaudin F, Verlhac S, Freard F, Roudot-Thoraval F, Benkerrou M, Thuret I,Mardini R, Vannier JP, Ploix E, Romero M, Casse-Perrot C, Helly M, Gillard E,Sebag G, Kchouk H, Pracros JP, Finck B, Dacher JN, Ickowicz V, Raybaud C, Poncet M, Lesprit E, Reinert PH, Brugieres P. A multicenter prospective study of children with sickle cell disease:radiographic and psychometric correlation.J Child Neurol. 2000 May;15(5):333-43. 7.
Verlhac S, Bernaudin F. DTC chez les enfants drépanocytaires.J Radiol. 2003, 84 :131-8..
Bernaudin F, Verlhac S, Coic L, Lesprit E, Brugieres P, Reinert P.
Long-term follow-up of pediatric sickle cell disease patients with abnormal high velocities on transcranial Doppler.Pediatr Radiol. 2005 Mar; 35 (3):242-8.
Adams RJ, McKie V, Nichols F et al. The use of transcranial ultrasonography to predict stroke in sickle cell disease. N E J Med 1992, 326, 9, 605-610
Adams RJ, McKie VC, Hsu L et a l: Prevention of a first stroke by transfusions in children with sickle cell anemia and abnormal results on transcranial Doppler ultrasonography. N Engl J Med 1998; 339: 5-11.
Ohene-Frempong K, Weiner SJ, Sleeper LA, Miller ST, Embury S, Moohr JW, Wethers DL, Pegelow CH, Gill FM. Cerebrovascular accidents in sickle cell disease: rates and risk factors. Blood 1998 Jan 1;91(1):288-94
Russell MO, Goldberg HI, Hodson A, et al. Effect of transfusion therapy on arteriographic abnormalities and on recurrencce of stroke in Sickle Cell Disease. Blood 1984; 63, 1: 162-169
Beauvais P, Verlhac S, Bernaudin F : Complications neurologiques et vasculopathie cérébrale au cours de la drépanocytose. In Girot R : La drépanocytose, John Libbey Eurotext, Paris, 2003, 145-160
Complications ostéoarticulaires
Faure C, Verlhac S. Les manifestations squelettiques de la drépanocytose. In Begue P : La maladie drépanocytaire. Sandoz ed Rueil Malmaison, 1984, 149-167.
Dalton GP, Drummond DS, Davidson RS, Robertson WW Jr. Bone infarction versus infection in sickle cell disease in children. J Pediatr Orthop. 1996 Jul-Aug;16(4):540-4
Mankad VN, Williams JP, Harpen MD, Manci E,Magnetic resonance imaging of bone marrow in sickle cell disease: clinical, hematologic, and pathologic correlations.Blood. 1990 Jan 1; 75(1):274-83.
Bonnerot V, Sebag G, de Montalembert M et al Gadolinium-DOTA enhanced MRI of painful osseous crises in children with sickle cell anemia Pediatr Radiol. 1994; 24 (2):92-5
Sebag G, Bonnerot V, De Montalembert M et al. Imagerie par resonance magnetique dans la crise osseuse aigue drépanocytaire chez l’enfant.Hématologie et orthopédie. Monographie du groupe d’étude en orthopédie pédiatrique dans Pennecot GF, Touzet PH, Geop Ed (PARIS) Montpellier 1994 :91-6.
Cotten NA, Tlilane Z, Rose Cet al. Manifestations osteo-articulaires de la drépanocytose. Feuillets de radiologie 1995 ; 35 :466-71
Sadat-Ali M, al-Umran K, al Habdan I, al Mulhim F: Ultrasonography : can it differentiate between vasoocclusive crisis and acute osteomyelitis in sickle cell disease? J Pediatr Orthop. 1998 Jul-Aug;18(4):552-4.
Aloui N, Nessib N, Jalel C et al J Radiol. Douleurs osseuses fébriles chez l’enfant drépanocytaire : apport de l’IRM 2005 Nov; 86(11):1693-7
Hernigou P, Habibi A, Bachir D, Galacteros F The natural history of asymptomatic osteonecrosis of the femoral head in adults with sickle cell disease J Bone Joint Surg Am. 2006 Dec;88(12):2565-72
Steinberg ME, Hayken GD, Steinberg DR A quantitative system for staging avascular necrosis. J Bone Joint Surg 1995:77-B:34-41
William RR, Hussein SS, Jeans WD, Wali YA, Lamki ZA. A prospective study of soft-tissue ultrasonography in sickle cell disease patients with suspected osteomyelitis. Clin Radiol. 2000 Apr;55(4):307-10
Autres complications
Bardakdjian-Michau J. Le dépistage néonatal de la drépanocytose en France. Médecine Thérapeutique Pédiatrique 2008, 11, 1: 5-8
Montalembert de M. Organisation de la prise en charge clinique des enfants drépanocytaires dépistés en période néonatale. Médecine Thérapeutique Pédiatrique 2008, 11, 1: 9-11
Leblanc A, Retali B, May A, Lobut JB. Le suivi de proximité des enfants drépanocytaires. Médecine Thérapeutique Pédiatrique 2008, 11, 1: 25-31
Reinert P, Cohen R.Drépanocytose, quels vaccins et quand ? Médecine Thérapeutique Pédiatrique 2008, 11, 1: 32-34
Hau I, Coïc L. L'enfant drépanocytaire aux urgences Médecine Thérapeutique Pédiatrique 2008, 11, 1: 35-42
Quinet B, LespritE. Comment préparer les voyages des enfants drépanocytaires ? Médecine Thérapeutique Pédiatrique 2008, 11, 1: 43-46
Pondarré C Surveillance rénale au cours de la drépanocytoseMédecine Thérapeutique Pédiatrique 2008, 11, 1: 47-51
de MontalembertM. Retentissement cardiaque de la drépanocytose chez l'enfant. Médecine Thérapeutique Pédiatrique 2008, 11, 1: 52-54
Verlhac S, Bernaudin F. Place du Doppler transcrânien et de l'imagerie en résonance mag